Calcite
| Calcite | |
|---|---|
 | |
| Classificazione Strunz (ed. 10) | 5.AB.05[1] |
| Formula chimica | CaCO3[2] |
| Proprietà cristallografiche | |
| Sistema cristallino | trigonale[3] |
| Classe di simmetria | scalenoedrica ditrigonale[4] |
| Parametri di cella | a = 4,9896 Å, c = 17,061 Å, Z = 6, V = 367,85 ų[2] |
| Gruppo puntuale | 3 2/m[4] |
| Gruppo spaziale | R3c (nº 167)[4] |
| Proprietà fisiche | |
| Densità misurata | 2,7102(2)[2] g/cm³ |
| Densità calcolata | 2,711[2] g/cm³ |
| Durezza (Mohs) | 3[4] |
| Sfaldatura | perfetta lungo {1011}[5] |
| Frattura | concoidale[2] |
| Colore | bianco, grigio, giallo, rossastro, brunastro, verde, incolore, blu[3] |
| Lucentezza | vitrea, resinosa, cerosa, perlacea[2] |
| Opacità | da trasparente a translucida a opaca[4] |
| Striscio | bianco[3] |
| Diffusione | comune |
| Si invita a seguire lo schema di Modello di voce – Minerale | |
La calcite (simbolo IMA: Cal[6]) è un minerale molto comune del gruppo omonimo appartenente alla classe minerale dei "carbonati e nitrati" con la composizione chimica CaCO3 e quindi, da un punto di vista chimico, un carbonato di calcio.
Etimologia e storia
[modifica | modifica wikitesto]
La calcite, sotto forma di calcare, era già nota nell'antichità, e nell'antica Grecia veniva chiamata χάλιξ ('chálix' con il significato di "piccola pietra" o "ghiaia"), ma anche calcare. Il termine calx, usato nell'Impero Romano, è considerato un prestito dal greco, ma il suo significato è solo per la calce grezza e spenta, che fungeva da malta. Il calcare utilizzato come materiale da costruzione è stato assegnato ai marmi.[7]
Il nome calcite per il minerale, che è valido ancora oggi, fu coniato nel 1845 da Wilhelm von Haidinger, che si opponeva al nome generale per tutte le sue forme (calcare, calcite, doppio longherone, latte di luna). Si basava sul termine generale calcaire di Jean-Claude Delamétherie e François Sulpice Beudant, che, tuttavia, rimase limitato alla lingua francese.[7][8]
Poiché la calcite era conosciuta e riconosciuta come specie minerale separata molto prima della fondazione dell'Associazione Mineralogica Internazionale (IMA), questa è stata adottata dalla sua "Commissione sui Nuovi Minerali, la Nomenclatura e la Classificazione" (CNMNC) e si riferisce alla calcite come un cosiddetto minerale "grandfathered" (G).[9]
La proprietà della calcite di poter cristallizzare in tutte le forme e combinazioni del sistema romboedrico ha avuto un significato per la derivazione delle leggi della cristallografia che non deve essere sottovalutato. Ad esempio, il medico inglese William Pryce aveva già anticipato le basi della cristallografia nel 1778 quando affermò nei Mineralogia Cornubiensis che tutte le forme di calcite derivano dalla forma base del romboedro per semplice scissione. Su questa base, il mineralogista francese René Just Haüy (1743-1822) sviluppò la prima cristallografia che poteva essere utilizzata anche nella pratica. Come spesso accade, anche la scoperta di Haüy è avvolta da una leggenda; Haüy gettò un grosso cristallo di calcite dal tavolo al pavimento chee si frantumò in molti pezzi. Mentre raccoglieva i frammenti, Haüy notò che, sebbene avessero tutti una forma diversa, somigliavano tutti al longarone islandese romboedrico. Haüy ripeté il processo con le diverse forme cristalline di calcite e ogni volta la prova restituì un romboedro. Da questa osservazione, concluse che i cristalli derivano dalla ripetizione del reticolo elementare o della cella elementare nelle tre direzioni spaziali. Registrò le sue osservazioni nel 1781 e nel 1782 nel suo libro Memoire sur la structure des crystaux. In esso, le leggi di base della cristallografia sono state formulate per la prima volta e spiegate utilizzando l'esempio della calcite.[10]
Classificazione
[modifica | modifica wikitesto]Sistematica dei lapis (Lapis-Systematik) di Stefan Weiß, che è stata rivista l'ultima volta nel 2018, al minerale è stato assegnato il numero di sistema e minerale V/B.02-020. Ciò corrisponde anche a quello della sottoclasse dei "carbonati anidri [CO3]2-, senza anioni estranei", dove la calcite forma il "gruppo della calcite" insieme a gaspéite, magnesite, otavite, rodocrosite, siderite, smithsonite, sferocobaltite e vaterite.[11]
La nona edizione della sistematica dei minerali di Strunz, che è stata aggiornata l'ultima volta dall'Associazione Mineralogica Internazionale (IMA) nel 2009,[12] classifica la calcite nella classe "5. Carbonati (nitrati)" e da lì nella sottoclasse "5.A Carbonati senza anioni aggiuntivi, senza H2O"; questa viene ulteriormente suddivisa in base agli elementi chimici presenti nel minerale in modo che la calcite possa essere trovata nella sezione "5.AB Carbonati di metalli alcalino terrosi (e altri M2+)" dove forma il sistema nº 5.AB.05 insieme a magnesite, rodocrosite, siderite, otavite, smithsonite, gaspéite e sferocobaltite.
Tale classificazione è proseguita dal database "mindat.org", chiamata anche Classificazione Strunz-mindat, dove la calcite conserva la classificazione che aveva nella nona edizione di Strunz.[1]
Nella classificazione dei minerali secondo Dana, utilizzata principalmente nel mondo anglosassone, la calcite ha il numero di sistema e minerale 14.01.01.01, che corrisponde alla classe dei "carbonati, nitrati e borati" e quindi alla sottoclasse dei "carbonati anidri". Qui forma il "gruppo della calcite (Trigonale: R3c)" con il sistema nº 14.01.01 nell'ambito della suddivisione "carbonati anidri con formula semplice A+CO3".[13]
Abito cristallino
[modifica | modifica wikitesto]La calcite cristallizza nel sistema trigonale nel gruppo spaziale R3c (gruppo nº 167) con i parametri del reticolo a = 4,99 Å e c = 17,06 Å oltre a 6 unità di formula per cella unitaria.[14]
La struttura cristallina è costituita da una disposizione a strati di gruppi piani di CO3 e ottaedri di calcio legati agli angoli costruiti lungo l'asse c [0001]. Ogni ione ossigeno del gruppo CO3 è associato a uno ione calcio dello strato sottostante e dello strato sovrastante, formando così una rete tridimensionale.[14]
Proprietà
[modifica | modifica wikitesto]Proprietà fisiche
[modifica | modifica wikitesto]-
Illustrazione dell’elevata birifrangenza di un grande cristallo singolo di calcite
-
Comportamento della luce LASER attraverso un blocco di calcite
-
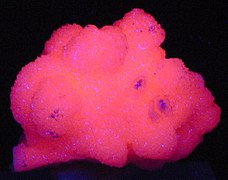
Campione di calcite (rosa) e quarzo (violetto) proveniente dal Messico sotto luce ultravioletta
Caratteristica dei cristalli di calcite è una birifrangenza particolarmente elevata. La luce che non cade lungo l'asse ottico del cristallo viene divisa in due fasci di luce, uno ordinario e uno straordinario. A questi due raggi si applicano indici di rifrazione diversi a causa delle diverse direzioni di polarizzazione. Ciò è dimostrato dal fatto che a un certo angolo di visuale, ogni oggetto osservato attraverso un cristallo chiaro appare due volte, una proprietà molto utile per l'identificazione della calcite.
La calcite è utilizzata nella costruzione del prisma di Nicol, uno dei primi polarizzatori.
La densità teorica della calcite è di 2,71 g/cm³. Tuttavia, la densità effettiva varia tra 2,6 e 2,8 g/cm³, a seconda di quanti ioni calcio nel reticolo cristallino vengono sostituiti da altri ioni metallici come ferro, manganese o zinco.[10]
A seconda del luogo in cui è stata trovata, la calcite può emettere fluorescenza nei colori rosso, blu o giallo, ma anche in altri colori, a causa dell'immagazzinamento di terre rare[15] sotto la luce ultravioletta. Inoltre, sono state trovate anche calciti fosforescenti, catoluminescenti, termoluminescenti e raramente triboluminescenti.[5]
Proprietà chimiche
[modifica | modifica wikitesto]Rispetto ad altri minerali, la calcite è poco resistente agli agenti atmosferici. È molto più morbida del quarzo o del feldspato ed è solubile in acqua acida. Negli acidi freddi e diluiti, la calcite si dissolve con violenta evoluzione di gas, inoltre è completamente solubile in acido cloridrico, con una tipica e vivace effervescenza.[3]
Colorazioni
[modifica | modifica wikitesto]-
Manganocalcite color rosa tenue alla luce del giorno
-
Lo stesso campione di manganocalcite sotto la luce ultravioletta
La calcite pura è trasparente e incolore. Tuttavia, si trova raramente in natura. A parte lo spato d'Islanda, la calcite naturale è solitamente di colore dal giallo miele al giallo-marrone, le varietà massicce sono di colore bianco latte. I diversi colori della calcite si formano quando ioni di altri metalli come ferro, zinco, cobalto o manganese sostituiscono gli ioni calcio nel reticolo cristallino. Ad esempio, il ferro dà una tonalità giallo-marrone, lo zinco porta a una tonalità bianco-grigiastra, il cobalto dà sfumature rosa e il manganese dà infine toni malva o viola. Inoltre, le varietà contenenti manganese sono spesso fluorescenti nel rosso carminio.

Se una piccola quantità di malachite viene mescolata con la calcite, può anche assumere un colore verde, come si può osservare nelle vene secondarie di calcite del massiccio calcareo di Vizarron nel Messico centrale. Queste, così come tutte le altre colorazioni sopra menzionate, evidenziano spesso singole zone di crescita dei cristalli di calcite e possono essere osservate abbastanza frequentemente. La calcite con un colore da blu cielo a lavanda è insolita, la cui colorazione può essere fatta risalire a difetti nel reticolo cristallino che si sono formati dalla radiazione di minerali radioattivi. La tonalità blu si indebolisce nel tempo e scompare completamente dopo pochi mesi quando i cristalli sono esposti al sole.[10]
Modificazioni e varietà
[modifica | modifica wikitesto]Il carbonato di calcio è trimorfico e si trova in natura come aragonite, che cristallizza nel sistema ortorombico e vaterite, che cristallizza nel sistema esagonale, oltre alla calcite trigonale.
Antracolite o antraconite è il nome di una varietà di calcite nera, ricca di carbonio o bituminosa.[16]
La varietà spato satinato è costituito da calcite a grana fine[17] con una lucentezza simile alla seta sulle superfici.
Esiste anche una varietà di calcite con un habitus pseudoesagonale a colonna lunga.[18]
La cobaltocalcite è il nome dato alle varietà di colore dal rosa scuro al rosa chiaro a causa della miscela di cobalto. Le manganocalciti sono anche note per essere tinte di rosa pallido da miscele di manganese.[19]
Uno pseudomorfismo da calcite a ikaite è chiamato glendonite.
Origine e giacitura
[modifica | modifica wikitesto]La calcite si forma in base all'equilibrio chimico:
L'equilibrio di questa reazione si sposta sempre più verso destra all'aumentare della temperatura. In acque calde, gli organismi viventi possono quindi formare gusci calcarei con un minor dispendio energetico. Nelle caldaie a vapore e in altri recipienti in cui viene riscaldata l'acqua calcarea, in questo modo si formano le incrostazioni.
La calcite può presentarsi sia in forma solida che granulare, fibrosa o in cristalli e in quest'ultimo caso mostra la più alta ricchezza di forme di tutti i minerali. Come minerale che forma le rocce, è uno dei più comuni nella crosta terrestre e si trova sia nelle rocce ignee, ad esempio nelle carbonatiti, sia nelle rocce metamorfiche (marmo) o sedimentarie come il calcare. Si presenta da sola o in associazione con molti altri minerali come dolomite, celestina, fluorite, barite, pirite, marcasite, sfalerite (nelle vene a basse temperature), oppure in associazione con zeoliti, calcedonio, clorite (in formazioni vescicolari); infine associata a talco, tremolite, grossularia, quarzo (nelle rocce metamorfiche) e a nefelina, diopside, apatite e ortoclasio (nelle rocce ignee).[5] La calcite si è spesso formata per biomineralizzazione, sia in formazioni rocciose, nel terreno, come placca dentale indesiderata, ma qui sempre in condizioni micro-ambientali molto specifiche.[20]
La calcite si dissolve bene in acqua acida[3] e di conseguenza viene facilmente lisciviata dal calcare, creando sistemi di grotte. La calcite disciolta si deposita altrove. Questo crea le tipiche stalattiti e stalagmiti.
I depositi di calcite di gran lunga più grandi possono essere ricondotti a depositi marini. Nel processo, gli scheletri contenenti calcite e le conchiglie di innumerevoli piccoli animali marini come cozze, coralli e vari protisti, come i coccolitoforidi, si depositano sul fondo del mare. Queste alghe calcaree sono più piccole di 30 micrometri e sono classificate come nanoplancton. Formano minuscoli scudi calcarei, i cosiddetti coccoliti, che affondano sul fondo dell'oceano dopo la morte delle alghe. Le scogliere di gesso di Dover sono costituite da tali coccoliti. Anche le barriere coralline svolgono un ruolo di primo piano nella formazione della calcite.
Le aree di formazione inorganica e abiogenica della calcite sono piattaforme marine tropicali poco profonde. Lì, la calcite viene precipitata sotto forma di sfere di dimensioni millimetriche (chiamate calcoidi). La calcite nel marmo è dovuta al metamorfismo termico dei sedimenti di calcite.
Da una profondità marina di 3500 metri, la cosiddetta profondità di compensazione della calcite, la calcite si dissolve completamente in acqua. Pertanto, a questa profondità non rimangono né sedimenti contenenti calcite, né gusci di cozze o scheletri.
La calcite si trova anche come incorporazione nella membrana statolitica degli organi maculari dell'orecchio interno. Svolge un ruolo importante nella percezione delle accelerazioni e della direzione perpendicolare.
La calcite, essendo molto comune, è stata trovata in moltissimi siti spari per il mondo. L'Islanda è particolarmente nota per i suoi straordinari ritrovamenti di calcite, dove sono stati trovati i cristalli più grandi. A Helgustadir, vicino a Reyðarfjörður, il cristallo più grande aveva dimensioni di 7 m × 7 m × 2 m e il più pesante pesava 280 tonnellate.[21] Nella grotta "Sterling Bush" nella contea di Lewis (Stato di New York), è stato trovato un romboedro di calcite di 109 cm × 95 cm × 46 cm e un peso di circa 500 kg.[22]
Una delle calciti più grandi esposte nei musei, del peso di 230 kg, si trova nel Museo di Storia Naturale di Londra.[23]
In Italia la calcite è stata rinvenuta a Berceto (Emilia Romagna) e a Monteviale (Veneto).[24]
Forma in cui si presenta in natura
[modifica | modifica wikitesto]La calcite cristallizza nel sistema trigonale e sviluppa diverse forme cristalline o aggregate. Nella sua forma pura, la calcite è incolore e trasparente. Tuttavia, a causa della rifrazione multipla della luce dovuta a difetti di costruzione del reticolo o alla formazione policristallina, può anche apparire bianca, per cui la trasparenza diminuisce di conseguenza, e assumere un colore giallo, rosa, rosso, blu, verde, marrone o nero a causa di miscele estranee.[3][5]
Con una durezza Mohs di 3, la calcite è uno dei minerali medio-duri, il che significa che può essere graffiata con una moneta di rame.[4]
Utilizzi
[modifica | modifica wikitesto]Come pietra preziosa
[modifica | modifica wikitesto]
La calcite è in realtà troppo morbida per la produzione commerciale di pietre preziose e anche troppo sensibile a causa della sua completa sfaldatura. Occasionalmente, tuttavia, viene offerto in forma di taglio liscio come cabochon o pietra burattata. I tagliatori esperti riescono anche a modellare la calcite con varie sfaccettature.[25]
Nella navigazione
[modifica | modifica wikitesto]Il doppio spato potrebbe essere stato utilizzato dai vichinghi come aiuto alla navigazione durante i loro viaggi. A causa delle sue proprietà birifrangenti, quando il sole viene visto attraverso un tale cristallo, vengono prodotti due fasci di luce, la cui intensità dipende dall'angolo di incidenza della luce solare. Se entrambi i raggi di luce sono identici in intensità, il cristallo è allineato con il sole. I ricercatori hanno scoperto in un esperimento che funziona in modo affidabile anche in condizioni nuvolose e anche fino a 40 minuti dopo il tramonto.[26][27][28]
Edilizia
[modifica | modifica wikitesto]Alcune tra le rocce costituite prevalentemente da questo minerale sono tra le più richieste e famose dal punto di vista edile e architettonico.
Si ricordano:
- le masse fibrose colorate che prendono il nome di alabastro
- le formazioni di ambiente carsico come il travertino, di cui è formato il Colosseo di Roma e il tufo carbonatico
- le rocce carbonatiche metamorfizzate, che vanno a costituire il marmo in tutte le sue varianti
Carsismo
[modifica | modifica wikitesto]Uno dei tanti fenomeni collegati alla calcite è il carsismo. Le rocce carsiche sono infatti principalmente calcari, composti di calcite e le acque meteoriche esercitano sui calcari erosione meccanica e chimica. La calcite è insolubile in acqua, ma diventa solubile se l'acqua è leggermente acida, a causa del diossido di carbonio (CO2) in essa disciolto. L'acqua si acidifica prelevando anidride carbonica (CO2) dall'atmosfera e dal suolo, formando acido carbonico secondo la reazione:
L'acido carbonico a sua volta reagisce con la calcite (CaCO3), formando bicarbonato di calcio Ca(HCO3)2. Questa reazione è reversibile, depositando la calcite, anche se il processo è più lento. L'erosione causa dissoluzione del calcare, formando doline, grotte, e altri aspetti caratteristici del territorio carsico.
Note
[modifica | modifica wikitesto]- ^ a b (EN) Strunz-mindat (2024) Classification - Alkali-earth (and other M2+) carbonates, su mindat.org. URL consultato il 13 novembre 2024.
- ^ a b c d e f (EN) Calcite, su mindat.org. URL consultato il 13 novembre 2024.
- ^ a b c d e f (DE) Calcite, su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ a b c d e f (EN) Calcite Mineral Data, su webmineral.com. URL consultato il 13 novembre 2024.
- ^ a b c d (EN) Calcite (PDF), in Handbook of Mineralogy, Mineralogical Society of America, 2001. URL consultato il 13 novembre 2024.
- ^ (EN) Laurence N. Warr, IMA–CNMNC approved mineral symbols (PDF), in Mineralogical Magazine, vol. 85, 2021, pp. 291–320, DOI:10.1180/mgm.2021.43. URL consultato il 12 novembre 2024.
- ^ a b Lüschen p. 246
- ^ (DE) Wilhelm von Haidinger, Handbuch der bestimmenden Mineralogie : enthaltend die Terminologie, Systematik, Nomenklatur und Charakteristik der Naturgeschichte des Mineralreiches, Vienna, Braumüller & Seidel, 1845, pp. 464–465. URL consultato il 13 novembre 2024.
- ^ (EN) Malcolm Back et al., The New IMA List of Minerals – A Work in Progress – Updated: September 2024 (PDF), IMA/CNMNC, Marco Pasero, settembre 2024. URL consultato il 13 novembre 2024.
- ^ a b c (DE) Wolfgang F. Tegethoff, Calciumcarbonat. Von der Kreidezeit ins 21. Jahrhundert, Springer-Verlag, 2013, p. 10, ISBN 978-3-0348-8259-0. URL consultato il 13 novembre 2024.
- ^ (DE) Lapis Classification - V NITRATE, CARBONATE UND BORATE - V/B Wasserfreie Carbonate [CO3]2-, ohne fremde Anionen, su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ (EN) Ernest Henry Nickel e Monte C. Nichols, IMA/CNMNC List of Minerals 2009 (PDF), su cnmnc.units.it, IMA/CNMNC, gennaio 2009. URL consultato il 12 novembre 2024 (archiviato dall'url originale il 29 luglio 2024).
- ^ (EN) Classification of Calcite, su mindat.org. URL consultato il 13 novembre 2024.
- ^ a b Strunz&Nickel p.286
- ^ Rösler p. 695
- ^ (DE) Anthraconite (Anthrakolith), su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ Henn p. 10
- ^ (DE) Calcite (Kanonenspat), su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ (DE) Manganoan Calcite (Manganocalcit), su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ (EN) Karl-Erich Schmittner e Pierre Giresse, Micro-environmental controls on biomineralization: superficial processes of apatite and calcite precipitation in Quaternary soils, Roussillon, France, in Sedimentology, vol. 46, n. 3, 1999, pp. 463–476, DOI:10.1046/j.1365-3091.1999.00224.x. URL consultato il 13 novembre 2024.
- ^ (DE) Rekorde im Mineralbereich, su mineralienatlas.de. URL consultato il 13 novembre 2024.
- ^ (EN) Charles Palache, The largest crystal, in American Mineralogist, vol. 17, 1932, pp. 362–363. URL consultato il 13 novembre 2024.
- ^ (EN) Krassmann, Giant Iceland Spar from Helgustadir, Iceland, su mineral-exploration.de, 28 febbraio 2018. URL consultato il 13 novembre 2024.
- ^ (EN) Localities for Calcite, su mindat.org. URL consultato il 13 novembre 2024.
- ^ Schumann p. 224
- ^ (DE) Wikinger nutzten transparentes Mineral als Sonnenkompass, su scinexx.de, scinexx das wissensmagazin, 2 novembre 2011. URL consultato il 13 novembre 2024.
- ^ (EN) Guy Ropars, Gabriel Gorre, Albert Le Floch, Jay Enoch e Vasudevan Lakshminarayanan, A depolarizer as a possible precise sunstone for Viking navigation by polarized skylight, in Proceedings of the Royal Society A, 2011, DOI:10.1098/rspa.2011.0369. URL consultato il 13 novembre 2024.
- ^ (EN) Albert Le Floch, Guy Ropars, Jacques Lucas, Steve Wright, Trevor Davenport, Michael Corfield e Michael Harrisson, The sixteenth century Alderney crystal: a calcite as an efficient reference optical compass?, in Proceedings of the Royal Society A, vol. 469, n. 2153, 2013, DOI:10.1098/rspa.2012.0651. URL consultato il 13 novembre 2024.
Bibliografia
[modifica | modifica wikitesto]- (DE) Ulrich Henn, Edelsteinkundliches Wörterbuch, Idar-Oberstein, Eigenverlag, 2001, ISBN 3-932515-24-2.
- (DE) Hans Lüschen, Die Namen der Steine. Das Mineralreich im Spiegel der Sprache, 2ª ed., Thun, Ott Verlag, 1979, ISBN 3-7225-6265-1.
- (DE) Hans Jürgen Rösler, Lehrbuch der Mineralogie, 4ª ed., Lipsia, Deutscher Verlag für Grundstoffindustrie (VEB), 1987, ISBN 3-342-00288-3.
- (DE) Walter Schumann, Edelsteine und Schmucksteine. Alle Arten und Varietäten. 1900 Einzelstücke, 16ª ed., Monaco, BLV Verlag, 2014, ISBN 978-3-8354-1171-5.
- (EN) Hugo Strunz e Ernest Henry Nickel, Strunz Mineralogical Tables. Chemical-structural Mineral Classification System, 9ª ed., Stoccarda, E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), 2001, ISBN 3-510-65188-X.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «calcite»
Wikizionario contiene il lemma di dizionario «calcite» Wikimedia Commons contiene immagini o altri file sulla calcite
Wikimedia Commons contiene immagini o altri file sulla calcite
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) R.V. Dietrich, calcite, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) satin spar, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Calcite Mineral Data, su webmineral.com.
| Controllo di autorità | Thesaurus BNCF 31081 · LCCN (EN) sh85018765 · GND (DE) 4121076-1 · BNF (FR) cb12218096s (data) · J9U (EN, HE) 987007293781005171 |
|---|